„A blog a TÁMOP 4.2.4.A/1-11-1-2012-0001 azonosító számú Nemzeti Kiválóság Program – Hazai hallgatói, illetve kutatói személyi támogatást biztosító rendszer kidolgozása és működtetése országos program című kiemelt projekt keretében valósul meg, az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával.”
2014. április 13., vasárnap
A Nemzeti Kiválóság Hírlevélben megjelent anyag
A Nemzeti Kiválóság Hírlevél márciusi számának 6. oldalán a blog által is megcélzott témában kifejtett kutatásaimról írnak. Az írás szabadon hozzáférhető itt:
http://www.nemzetikivalosag.hu/documents/10179/10351224/NKP_Hirlevel_2014-03_Marcius_FIN.pdf/a6aa509d-adcd-492f-84a0-26cf3ad6601c
2014. március 28., péntek
A sugárzás hatásának egy lehetséges modellezése. III. Rész: A légutakban kiülepedett radioaktív izotópok kölcsönhatása a sejtekkel
Jelen bejegyzésben
két biológiai végpontnak, nevezetesen a sejthalálnak és a sejttranszformációnak a
szimulációjáról lesz szó. Az előző két posztban láthattuk, hogy a rüvid felezési idejű radon leányelemek lokális légúti terhelése függ azok kiülepedési helyétől tisztulásától. A kiülepedett és még ki nem tisztult rövid felezési idejű alfa-bomló izotópok ha elbomlanak, akkor a kiülepedés helyéhez közeli sejteket alfa-találat érheti. E sejtekben energialeadás történik, melynek biológiai következményeit modellezhetjük. Ehhez ismernünk kell a bomlás során keletkező alfa-részecske kezdeti energiáját, a sejtekben egységnyi úthosszon leadott energiát, valamint a sejtszerkezetet. A rövid felezési idejű radon bomlástermékek közül a 218Po és a 214Po alfa-aktívak. Míg az előbbi egy 6 MeV-es, addig az utóbbi egy 7,69 MeV-es alfa-részecskét bocsát ki. A kibocsátás egyforma eséllyel történhet a tér bármely irányában, ezért a légutak falára kiülepedett alfa-bomló izotóp által kibocsátott alfa-részecske vagy behatol a szövetbe, vagy átrepül a légúton (a légút belsejében lévő levegőn) és a "túloldalon" csapódik be és lépik be a légúti hámsejtekbe. A levegőben leadott energia viszonylag kicsi a szövetben elnyelthez képest. A sejteken áthatoló alfa-részecske az energiáját nem egyenletesen adja le, hanem a Bragg-törvény szerint, vagyis minél mélyebben hatol be, annál több energiát képes leadni egységnyi úthosszon, mígnem energiája teljes elvesztésének közelében hirtelen lecsökken ezen érték.
A sejtekben a sugárzás hatására végbemenő folyamatok nagymértékben függnek attól, hogy mekkora energia (és dózis, ami energia/tömeg) nyelődött el bennük. Ez attól függ, hogy az eltalált sejtet mekkora úthosszon (húrhossz) metszi az alfa-nyom (alfa-részecske pályája) és mekkora ott az egységnyi úthosszra jutó leadott energia. Ennek kiszámításához modellezhetjük a tüdő hámszövetének sejteloszlását. Az irodalmi adatok alapján a sejtstruktúrát 3D számítógépes módszerekkel rekonstruálhatjuk. Két különböző típusú sugárérzékeny sejttípus eloszlását az alábbi ábrán láthatjuk. E sejtek a jobb oldalon lévő hámrétegben helyezkednek el, mely közvetlenül a bal oldalon megjelenített légút falához tapad.
Látható, hogy a sejthalál esélye a dózissal nő, illetve az is, hogy az inhomogén kiülepedés forró területén (elágazás csúcsa, ahol sok részecske kiülepszik) a sejthalál valószínűsége erősen megnő. Ugyanezen az ábrán szépen látszik a tisztulás kárcsökkentő szerepe is.
Ha most a sejttranszformációt vesszük alapul, akkor a neki megfelelő grafikon a következő lesz:
Az ábrán az látható, hogy a transzformáció esélye miként nő, ugyancsak az eltelt idő függvényében, a fenti három esetben (egyenletes kiülepedés, inhomogén depozíció tisztulás nélkül és egyenletlen kiülepedés tisztulással) ha a radon aktivitás koncentrációja 50 Bq/m3. Láthatjuk, hogy a transzformáció valószínűsége is nő a dózissal (besugárzási idővel), de az értéke sokkal kisebb, mint a sejthalálé. Megjegyzendő, hogy a fenti két ábrán csak a direkt hatások (csak az a sejt károsodik, amelyik a dózist kapja) vannak feltüntetve. A sejt-sejt kommunikáció miatt az indirekt hatások is szerepet kaphatnak és akkor a fenti görbék is módosulhatnak. Számos indirekt hatást ismerünk, például a gén instabilitás, a bystander hatás, az indukált apoptózis stb. Ezekbe most nem mennék bele, csupán annyit, hogy e hatások is modellezhetők, én példáil kifejlesztettem egy indukált apoptózis modellt.
Ha kiszámítottuk a sejtdózist, illletve annak eloszlását, akkor megbecsülhető a sejthalálban és a sejttranszformációban kifjezett biológiai hatás. A besugárzott sejt túlélési valószínüsége exponenciálisan csökken a dózissal. Ennek megfelelően, a sejthalál valószínűsége nő a kapott dózissal. Ezért, ha a dózist a modelljeinkkel jól becsöljük, akkor a sejthalál és annak térbeli és időbeli eloszlása is meghatározható. A transzformáció a rák felé vezető út egy fontos állomása. A sejt ezen állapotba jutása arányos a kapott dózissal, feltéve hogy a sejt túléli a sugárterhelést. Megjegyzem, hogy transzformáció valószínűsége sokkal kisebb, mint a sejthalálé. És akkor ennyi elmélet után lássunk egy-két eredményt. Elsőként egy sejthalál grafikont mutatok, ahol a vízszintes tengelyen a besugárzás időtartama látható, ami a dózissal arányos. Ennek függvényében, a függőleges tengelyen annak esélye szerepel, hogy a sejt elpusztul. A három görbe mutatja azt az esetet, amikor a légúti radioaktív részecske-kiülepedés homogén (zöld háromszögek), inhomogén és nincs tisztulás (kék négyzetek), illetve inhomogén és tisztulás is jelen van (piros pöttyök).
Látható, hogy a sejthalál esélye a dózissal nő, illetve az is, hogy az inhomogén kiülepedés forró területén (elágazás csúcsa, ahol sok részecske kiülepszik) a sejthalál valószínűsége erősen megnő. Ugyanezen az ábrán szépen látszik a tisztulás kárcsökkentő szerepe is.
Ha most a sejttranszformációt vesszük alapul, akkor a neki megfelelő grafikon a következő lesz:
2014. február 26., szerda
A sugárzás hatásának egy lehetséges modellezése. II. Rész: A légutakban kiülepedett radioaktív izotópok tisztulása
Miután az előző bejegyzésben a belélegzett radioaktív részecskék légzőrendszeri kiülepedését mutattam be, jelen posztot a tisztulásnak, mint védekező mechanizmusnak a részecskemennyiségre (összefüggésben áll a kapott dózissal) és eloszlásra gyakorolt hatásának szentelem.
Maga a nyák egy gél, amelynek nagy része víz, de többek között összegabalyodott polimerszálak is vannak benne, melyek többé-kevésbé egy rácsot alkotnak. Mikroszkópos felvételen ez valahogy így fest:
Látható, hogy az átlagos rácsméret néhány száz nanométer. Ennek az a következménye, hogy az ennél nagyobb részecskék elakadnak és együtt mozognak a nyákkal (nagyjából 1 mm/perc sebességgel), de a kisebb semleges részecskék szabadon diffundálnak a szálak között, akár a vízben.
A tudomány jelen állása szerint azonban nem minden részecskére hat e tisztulási forma és a részecskeméret csökkenésével előtérbe kerül a lassú tisztulás. A lenti ábra szerint, míg egy 7 mikronos részecske biztosan kitisztul a nyákkal, addig egy 1 mikron alatti csak 20-30 % eséllyel tud gyorsan (percek, órák, nap) kitisztulni. A lassú tisztulás úgy 20 napot jelent és pontos mechanizmusa nem ismert.
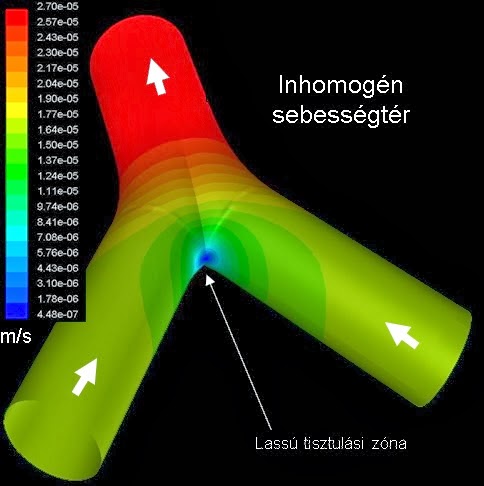
A nyáktisztulást, ugyanúgy mint a légzőrendszeri levegő- és részecskeáramlást, numerikus áramlástani eljárásokkal (CFD) lehet modellezni. A következő ábra a nyák sebességterét mutatja egy légúti elágazásban. A kék a kisebb, míg a piros szín a lokálisan nagyobb sebességet jelőli.
A légutak különböző régióiban kiülepedett részecskék káros hatása ellen a szervezet többek között úgy védekezik, hogy megpróbálja eliminálni azokat. Mivel a radioaktív részecskék miatti tüdőrák leggyakrabban a bronchiális régióban (hörgők) fordul elő, itt is az erre a régióra jellemző tisztulási mechanizmusokra szorítkozom. E régióban a legjelentősebb tisztulási formák a mukociliáris tisztulás (nyáktisztulás) és a lassú tisztulás.
A mukociliáris tisztulás a fő tisztulási mechanizmus a bronchiális légutakban a kiülepedést követő 48 órában. A légutak falán lévő csillószőrök koordinált csapkodással mozgatják a légutakat borító viszkózus nyákot, mely a garat irányába mozgatja a benne kitapadt részecskéket (onnan lenyeljük, kiköhögjük, kiköpjük). Valahogy így:
Maga a nyák egy gél, amelynek nagy része víz, de többek között összegabalyodott polimerszálak is vannak benne, melyek többé-kevésbé egy rácsot alkotnak. Mikroszkópos felvételen ez valahogy így fest:
Látható, hogy az átlagos rácsméret néhány száz nanométer. Ennek az a következménye, hogy az ennél nagyobb részecskék elakadnak és együtt mozognak a nyákkal (nagyjából 1 mm/perc sebességgel), de a kisebb semleges részecskék szabadon diffundálnak a szálak között, akár a vízben.
A tudomány jelen állása szerint azonban nem minden részecskére hat e tisztulási forma és a részecskeméret csökkenésével előtérbe kerül a lassú tisztulás. A lenti ábra szerint, míg egy 7 mikronos részecske biztosan kitisztul a nyákkal, addig egy 1 mikron alatti csak 20-30 % eséllyel tud gyorsan (percek, órák, nap) kitisztulni. A lassú tisztulás úgy 20 napot jelent és pontos mechanizmusa nem ismert.
A nyáktisztulást, ugyanúgy mint a légzőrendszeri levegő- és részecskeáramlást, numerikus áramlástani eljárásokkal (CFD) lehet modellezni. A következő ábra a nyák sebességterét mutatja egy légúti elágazásban. A kék a kisebb, míg a piros szín a lokálisan nagyobb sebességet jelőli.
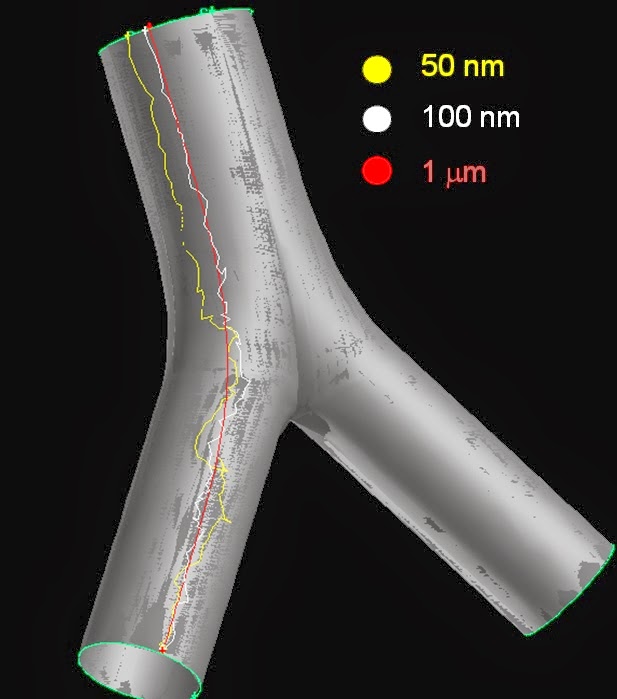
Látható, hogy amint a nyák felfele kúszik, az elágazás csúcsában lelassul. Ha visszaemlékszünk, ez volt az a hely, ahol a radioaktív részecskék a legnagyobb számban ülepedtek ki. Ha nemcsak a nyák, hanem a részecskék mozgását is modellezzük a kiülepedés után, akkor a lentiekhez hasonló pályákat kapunk:
Az ábrán láthatjuk, hogy minél kisebb egy részecske, annál többet bolyong, ami a nyák fent említett rácsos struktúrájával van összefüggésben. Mindez konkrét radonszármazékokra igy néz ki:
Azok a pályák, amelyek végigmennek az Y elágazáson, olyan részecskéknek felelnek meg, melyek a légutak mélyebb régióiból jönnek tisztulás által és átutaznak az elágazáson, míg azok amelyek végpontja az elágazásban kezdődik az oda kiülepedett részecskékhez rendelhetők. Ahol a vonalak színe megváltozik, ott bomlás történik. A bomlás helyét és a neki megfelelő energiát lejegyezzük, mert a biológiai hatás modellezésekor ebből indulunk ki. Mindezt a következő bejegyzésben fogom bemutatni.
Mindent egybevetve, a szimulációk azt mutatják, hogy a tisztulás nagymértékben csökkenti a kapott dózist és kisebb mértékben a dóziseloszlás inhomogenitását.
Hogy ezt hogyan köthetjük össze a konkrét biológiai hatással, azt a soron következő alkalommal vázolom.
2014. január 26., vasárnap
A sugárzás hatásának egy lehetséges modellezése. I. Rész: A radioaktív izotópok útja és kiülepedése a légutakban
A következőkben egy 3 részesre tervezett modellezésről szóló izelítő első részéről olvashattok/olvashatnak. Ennek során áttekintem miként modellezhető a légzőrendszerbe jutó izotópok transzportja és kiülepedése. A folytatásban a kiülepedett radioaktív részecskék tisztulásáról lesz szó, majd a harmadik részben a radioaktív részecske-sejt kölcsönhatás szimulációját mutatom be.
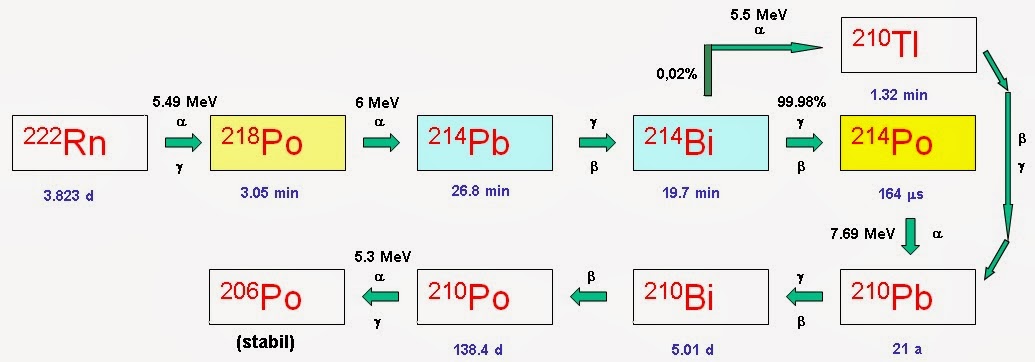
A természetes háttérsugárzásból származó radioaktív sugárterhelés több mint felét a radon leányelemeitől kapjuk. A radon gáz bomlása során 218Po keletkezik, mely alfa-aktív és nagyjából 3 perces felezési idővel 214Pb-re bomlik, majd a 214Bi-en keresztül a 214Po-hoz jutunk, ami szintén alfa-aktív. Elbomlása során 210Pb keletkezik, amely már nem rövid felezési idejű. A pontos bomlási lánc az alábbiakban látható.
A fenti radontermékek vízmolekulákkal együtt, vagy a légköri aeroszolokra tapadva vannak jelen a levegőben, ahonnan belélegezzük őket. A légzőrendszerben kitapadva elbomolhatnak és károsíthatják a sejteket/szövetet. A kár szempontjából leginkább az alfa-bomló izotópok a figyelemre méltóak (218Po, 214Po). A belélegzett izotópok légúti kiülepedését és bomlását matematikai/fizikai modellekkel tudjuk leírni. Ehhez modelleznünk kell azok pályáit, amint a levegőárammal repülnek, majd esetleg a légút falának ütköznek. A levegő és részecskeáramlást modellezhetjük idealizált, vagy CT képekből rekonstruált háromdimenziós légutakban is. Rekonstruált felső (bal oldal) és centrális (jobb oldal) légúti geometriák digitális modelljei az alábbiakban láthatók.
A levegő áramlási tere e geometriákban igen bonyolult, de a légutakban áramló levegő sebessége és nyomása numerikus áramlástani módszerrel kiszámítható. Ilyen sebességteret szemléltet az alábbi ábra. A kék jelenti a kis, a piros pedig a nagy sebesség értékeket. A számításokat a FLUENT nevű CFD (computational fluid dynamics, numerikus áramlástan) szoftverrel végeztem.
A kiszámított levegőáramlási térbe részecskéket helyezve követhető, hogy azok hol csapódnak a légutak falának. A kicsapódó részecskék beleragadnak a légutak falát borító nyákba. Az 1 és 10 mikrométeres részecskék kiülepedési mintázatát az alábbi ábrán láthatjuk nyugodt légzésnek megfelelő áramlási viszonyok (térfogatáram = 18 liter/perc) mellett. A kiülepedéseloszlás erősen inhomogén, melynek következtében egyes területek nagyobb sugárterhelést kapnak ha a kiülepedett részecskék elbomlanak.
A kiülepedett rövid felezési idejű izotópok ha elbomlanak, akkor a kiülepedés helyéhez közeli sejteket alfa-találat érheti, azokban energialeadás történik, melynek biológiai következményeit szintén lehet modellezni. De még mielőtt e fontos lépést bemutathatnám, fontos megjegyezni, hogy a fenti ábrán látahtó kiülepedési képeket módosíthatja még a mukociliáris tisztulás is, melynek modellezéséről a következő bejegyzésben lesz szó. Azt követi majd a részecske-élő anyag interakció modellezésének bemutatása.
Feliratkozás:
Bejegyzések (Atom)